アルカリ金属の溶解・自発的イオン化・溶媒和電子の生成
前のページへ戻る。
| なぜ、アルカリ金属の溶解過程を研究するのか |
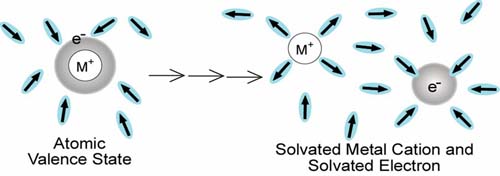
アルカリ金属が水やアンモニアに溶解する際、金属原子の最外殻電子(Liなら2s、Naなら3sなど)は始めは金属原子に束縛されたいますが、いずれ外からエネルギーをもらうことなしに金属から離れて溶媒側に移ります。この過程で電子分布(電子の存在する確率の高い場所)は、どのように移り変わっていくのでしょうか。電子移動は化学反応の中心的課題の一つです。アルカリ金属は、原子力発電施設に使われる重要な素材であり、このような基礎的分子過程の理解を深めることは、安全設計を行う大前提です。そもそも、金属が自発的にイオン化するのに最少いくつの溶媒分子が必要なのでしょうか?また、金属から離れた電子はどこへ行くのでしょう?
|
| 実験でわかること、わからないこと |
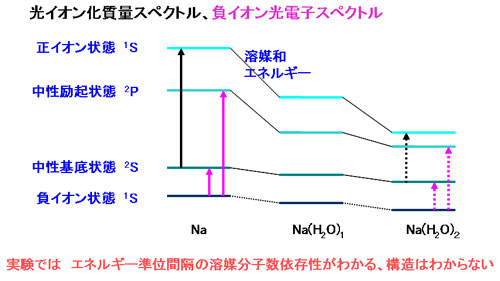
レーザーを使った分光学的実験で、金属に溶媒が一つ二つ、、とついたときのイオン化ポテンポテンシャルなどを測ることができます。これらは、溶媒和によって電子基底状態、励起状態、イオン化状態のエネルギー差がどの様に変化するかを教えてくれます。しかし、どんな向きや形で溶媒が結合しているかを知ることは難しく、またなぜその形をしているか、その形のとき電子的にどんな変化が起こっているのかはわかりません。理論計算では、実験でわからないことを調べることができます。
|
| 理論計算で溶液の局所構造を観る |
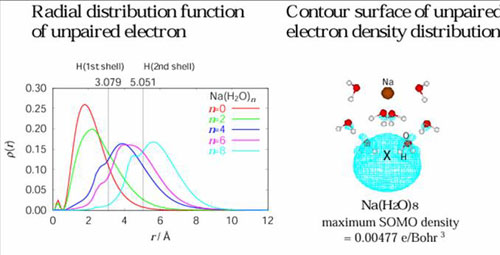
左の図はNaに水が0,2,4,6,8とついて(溶媒和して)行く過程で3s電子の動径分布関数がどのように変化するかを表しています。水の数が増えると関数の山は低く広くなっていくことが解ります。水和により電子の空間分布は急速に広がり、4つで[Na(H2O)4]+の外側を希薄な電子の霧(雲)が取り囲むようになります(1中心リドベルグ様状態)。水が4つあれば電子をNaから剥ぎ取るのに十分です。右の図は、[Na(H2O)8]の中でNaから離れた不対電子の雲がどこに分布しているかを示します。電子は第二層の水には挟まれるように集まってきます(局在化)。私たちはこのような状態を始めはLiで見つけ、そしてNaにも研究を発展させました。溶媒がアンモニアの場合も研究して、金属の種類や溶媒の種類、組み合わせでどんなことが一般法則としていえるかを明らかにしています。
|
| 参考文献 |
|
これらの研究の内容や将来展望の解説
橋本 健朗 「理論計算によるクラスター研究:構造と電子状態」 先端化学シリーズIV(理論・計算化学、クラスター、スペースケミストリー)、 pp.134-139、2003、日本化学会、丸善 国際誌のレビュー(実験研究も含む) Kiyokazu Fuke, Kenro Hashimoto and Suehiro Iwata "Structures, Spectroscopies and Reactions of Atomic Ions With Water Clusters" In I.Prigogine and S. A. Rice eds., Advances in Chemical Physics Vol. 110 ,Chapter 7, pp.433-523, John Wiley and Sons, 1999, New York 論文(その他は、論文・総説のページにあります。 Claus Peter Schulz, Christiana Bobbert, Taku Shimosato, Kota Daigoku, Nobuaki Miura, and Kenro Hashimoto Electronically excited states of sodium-water-clusters J. Chem. Phys.,119(2003),11620-11629. |